中国胃肠胰神经内分泌肿瘤专家共识(2016年版)
中国胃肠胰神经内分泌肿瘤专家共识(2016年版)
胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms,GEP-NENs)主要发生在消化道或胰腺,能产生5-羟色胺代谢产物或多肽激素,如胰高血糖素、胰岛素、胃泌素或促肾上腺皮质激素等。
经过了3年的临床实践,结合国内、外的研究进展,专家委员会组织讨论,对于第1版中国 GEP-NENs诊治共识进行了修订更新,现在公布。在第2版共识中,NENs仍然包括所有高、中、低分化的神经内分泌肿瘤;NETs(neuroendocrine tumors)是指高、中分化的神经内分泌瘤;而NEC(neuroendocrinecarcinoma)则是指低分化的神经内分泌癌。由于2010年WHO有关分类的出台时间较短和需要不断完善,本共识引用的参考文献中,有关NENs分化程度及分级的标准可能会与WHO分类有不一致之处。
本共识共分为两部分,第一部分为胰腺神经内分泌肿瘤(pancreaticneuroendocrine neoplasms,pNENs),第二部分为胃肠道神经内分泌肿瘤(gastrointestinalneuroendocrine neoplasms,GI-NENs)。
1.流行病学
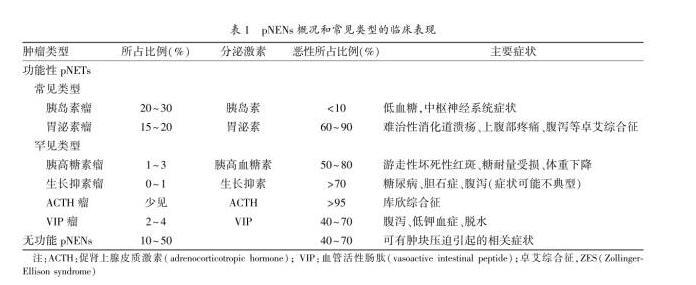
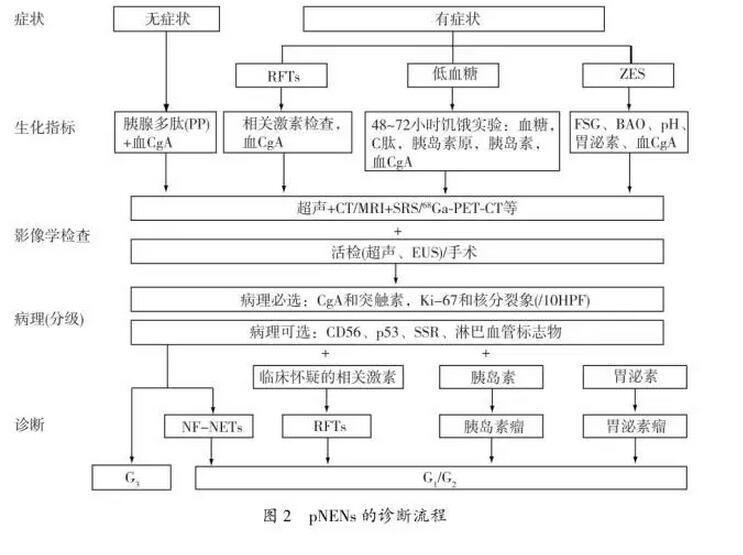
美国监测、流行病学与最终结果数据库(SEER)的数据显示,NENs的发病率和患病率明显上升;据估计,NENs发病率为5.25/10万,其中GEP-NENs占NENs的65%-75%。近年来,我国对GEP-NENs的报道亦逐渐增多,但是由于全国性登记系统尚不完善,对于国内现阶段GEP-NETs的流行趋势、临床特征以及防治状况仍不甚明晰,因此缺乏与其他国家/地区可比的详细数据和信息。2.2无功能性pNENs(non-function pNENs,NF-pNENs)约占所有pNETs的60%-90%。在血液和尿液中可能有激素水平的升高,但是并不表现出特异的症状或综合征。当肿瘤体积增大到一定程度时,可能出现肿瘤压迫的相关症状,如消化道梗阻和黄疸;也可能出现转移相关的症状。(1)MEN1:约20%的胃泌素瘤、<5%的胰岛素瘤或rfts为men-1。该类疾病通常以出现甲状旁腺、胰腺、十二指肠和垂体的肿瘤为特征,也常出现支气管和胸腺nets、肾上腺肿瘤、皮肤病灶、甲状腺疾病和脑膜肿瘤。(2)视网膜-小脑血管瘤疾病(Hippel-Lindau disease,VHL):10%~17%的VHL合并NF-pNETs,可累及多个器官组织,包括肾、肾上腺、中枢神经系统、眼、内耳、附睾及胰腺。(3)神经纤维瘤病1型(neurofibromatosis1,NF-1):常见的临床表现有皮肤出现牛奶咖啡斑、多发性神经纤维瘤、皮肤褶皱处的雀斑、虹膜错构瘤视神经胶质瘤和骨的发育异常。中枢神经系统异常表现为学习障碍、多动症和癫痫。(4)结节性硬化(Tuberous sclerosis,TS):<1%的患者合并pNETs。主要为神经-皮肤的多系统异常,表现为几乎所有器官的错构瘤,主要为结节性硬化症(tuberous sclerosis complex,TSC)1和TSC2的基因突变所致。患者可出现神经系统症状,皮肤改变以及错构瘤结节。少部分TS患有pNETs,通常为TSC2突变。pNENs肿瘤生长的位置和转移情况是决定能否根治性切除的关键。推荐的影像学检测手段,包括CT、MRI、生长抑素受体显像(somatostatin-receptor scintigraphy,SRS)、PET-CT、超声检查、超声内镜(Endoscopic ultrasound,EUS)、术中超声(intraoperative ultrasound,IOUS)及选择性血管造影等。包括生长抑素受体显像、正电子发射型计算机断层显像(positron emission tomography,PET)、PET-CT以及选择性血管造影(selective angiography,SAG)等。血浆嗜铬粒蛋白(chromogranin A,CgA)是NENs中最常用、最有效的肿瘤标志物,可用于协助诊断、指导治疗和评估疗效,还可用于肝转移患者的随访。应通过72小时饥饿试验进行诊断,即患者饥饿后出现低血糖症状时,如满足以下6条即可诊断:(1)血糖≤2.22mmol/l,(2)胰岛素水平≥6μU/ml,(3)C肽水平≥200pmol/l,(4)胰岛素原水平≥5pmol/l,(5)β-羟丁酸≤27mmol/l,(6)血/尿中无磺脲类药物的代谢产物。98%以上的胃泌素瘤患者的空腹血清胃泌素(fastserumgastrin,FSG)水平升高,但特异性不高。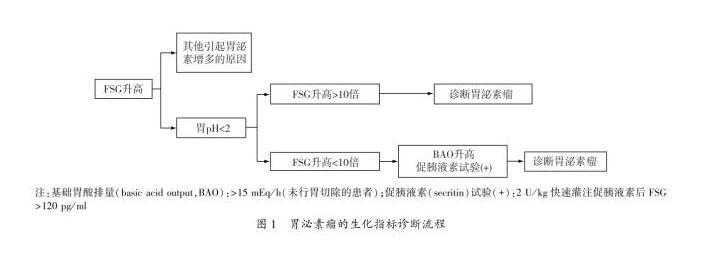
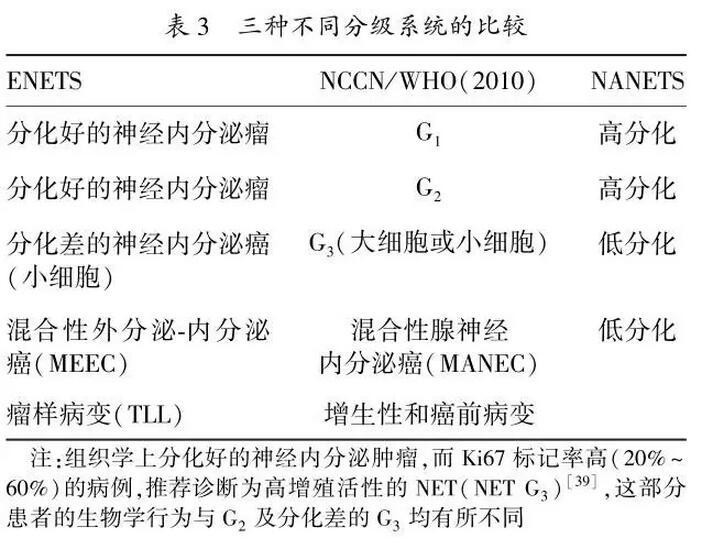
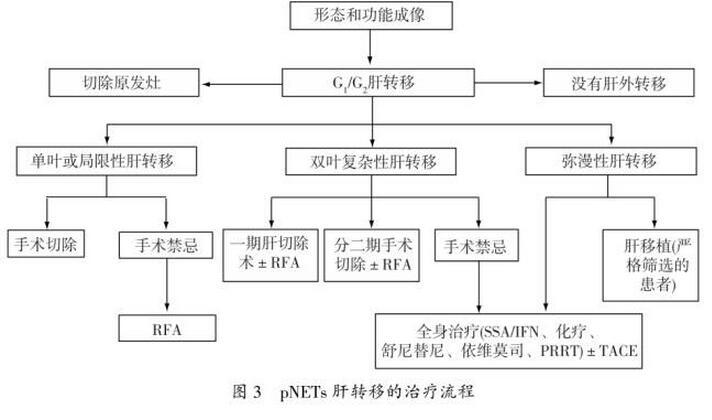
应当检查相关的激素水平,如怀疑胰高糖素瘤,应检测胰高血糖素等。与其他前肠NENs相比,pNENs并没有特殊的组织学特征。免疫组化检查必须包括CgA和突触素(synaptophysin,Syn);可选项目包括:CD56、特定激素、生长抑素受体2亚型、淋巴血管标记物和p53等。NENs应当按组织分化程度和细胞增殖活性进行分级。关于2010年WHO版NENs分级与以往的ENETS分级、NANETS分级的比较参见表3。本共识对于pNENs部分,推荐采用2010年WHO的TNM分期系统。(1)局限期pNENs:对于局限期pNENs,除非合并有危及生命的其他疾病或手术风险极高,原则上建议实施手术切除。(2)功能性pNET:①胰岛素瘤:所有胰岛素瘤,无论大小和是否为MEN-1,都应尽可能手术切除;85%~95%的患者可以通过手术治愈。手术方式可首选腹腔镜下切除。②胃泌素瘤:对于局限性胃泌素瘤患者(非MEN-1),建议行根治性切除及周围淋巴结清扫,治愈率达20%~45%。③RFTs:大多数RFTs较大且易发生肝转移,建议行开腹胰腺肿瘤根治术,联合淋巴结清扫。(3)局部进展期和转移性pNENs:对于局部复发、孤立的远处转移或不可切除的pNETs,经治疗后转为可切除病灶,如果患者体力状况允许,应考虑手术切除。(4)遗传性NETs:对于合并MEN1的功能性pNETs,建议手术切除;对于MEN1相关的无功能性pNETs,手术原则基本上同散发性pNETs。(5)需要注意的问题:①进展期pNETs患者手术后,若需要长期应用SSA治疗;如患者有胆囊结石,会增加患胆汁淤积和胆囊炎的风险,建议同时行胆囊切除术。②合并类癌综合征的患者在麻醉前,需静脉应用SSA,如奥曲肽,以防止出现类癌危象。R0/R1切除术后:目前尚无大规模的临床研究证据证明SSA、化疗和分子靶向药物等辅助治疗能使pNENs患者获益,故不推荐对于根治术后的G1/G2患者进行药物辅助治疗。R2切除术后:对于减瘤术后的患者,应当按晚期pNENs患者的治疗策略进行全身和局部治疗。可通过射频消融、动脉栓塞及选择性内放射治疗等局部治疗手段,控制肝转移灶,有效地减轻肿瘤负荷,减少激素分泌,改善患者的生活质量。(1)肝动脉(化疗)栓塞(Transcatheter arterial(chemo)embolization,TAE/TACE):TAE/TACE常用于控制pNENs的肝转移灶,有效率超过50%,对于症状缓解、肿瘤标志物下降以及影像学缩小的有效率分别为73%~100%、57%~91%和33%~50%,症状控制时间可达14~22个月,但是否能够延长患者的生存期尚无定论。对于肝转移灶无法切除、伴随的明显症状经SSA治疗也无法控制时,可以首选肝动脉化疗栓塞;常用的药物为多柔比星和顺铂。(2)射频消融治疗(radiofrequency ablation,RFA):对于小于5cm的肝转移瘤可行射频消融治疗,症状缓解率达70%~80%,缓解期可持续10~11个月。直径小于3cm且数量不多的肿瘤,建议行RFA联合手术切除。(3)肝移植:需要经过多学科讨论,严格掌握适应证。对于年轻<45岁、肿瘤原发灶已切除、同时无肝外转移和分化好的pNETs(G1/G2,Ki-67<10%),当其他手段难以控制临床症状时,肝移植可以作为一种治疗选择,5年生存率为48%~60%。7.4无法手术切除的局部晚期及转移性pNENs的药物治疗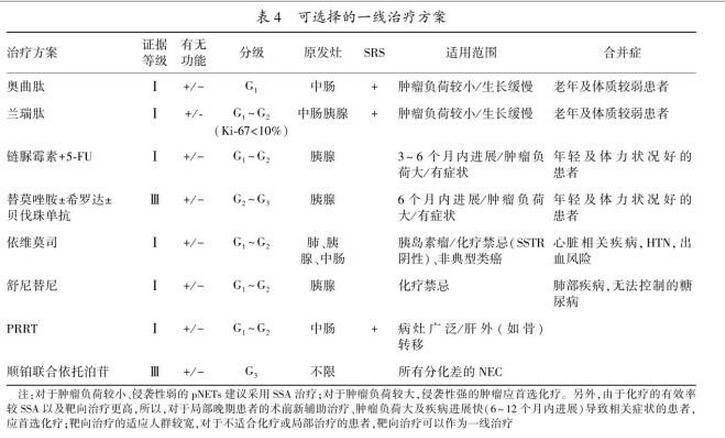
(1)抗增殖治疗:①生物治疗;②全身化疗;③靶向治疗;④肽受体放射性同位素治疗。
胰岛素瘤:患者可通过少食多餐、静脉输注葡萄糖来调节血糖。胃泌素瘤:组胺H2受体抑制剂(西咪替丁、雷尼替丁以及法莫替丁等)和PPI(奥美拉唑、兰索拉唑、泮托拉唑和雷贝拉唑等),能够控制胃酸过量分泌引起的ZES。其他功能性pNETs:SSA对于RFT的症状控制疗效显著,尤其对于胰高糖素瘤、生长激素瘤及VIP瘤患者。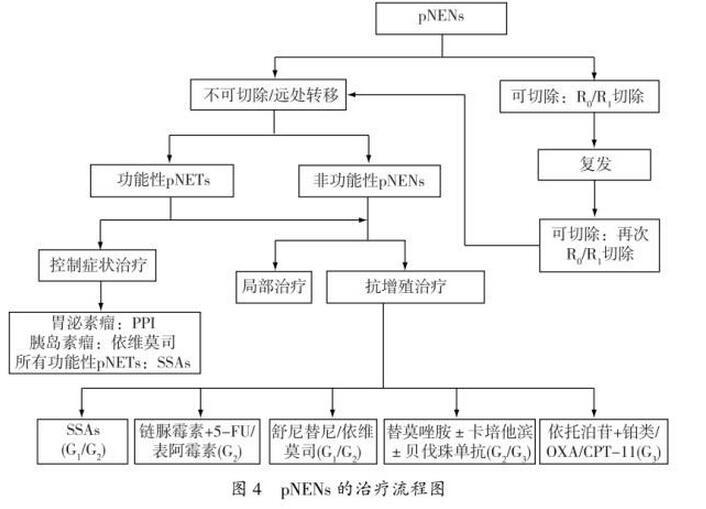
一般认为,所有的NETs都是具有恶性潜能的肿瘤,应该进行长期随访。根治性切除术后的pNETs,每6~12个月1次,至少需随访7年;若出现症状,应随时复查。对于未手术切除的低危患者,第1年应每3个月随访1次,以后每半年1次至少3年,之后每年随访1次。已有远处转移的pNENs患者,应当每3~6个月随访1次。接受治疗的患者随访时间需相应缩短,pNEC患者应按照腺癌的随访要求进行。随访项目推荐CT或MRI和血清CgA、NSE检查,对于表达生长抑素受体2α的pNENs,也可结合SRS进行随访。1.流行病学
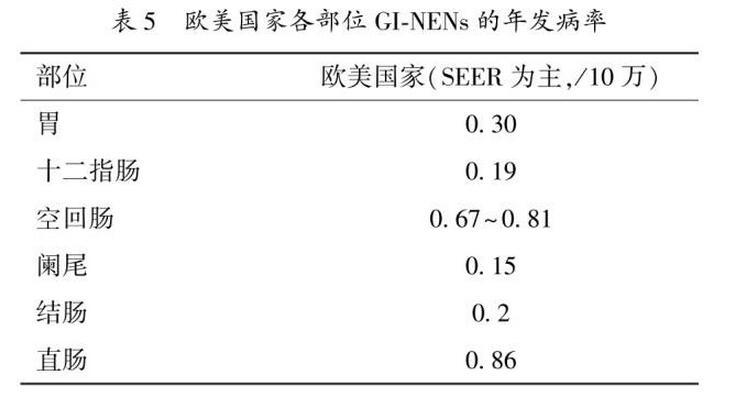
GI-NENs包括胃、十二指肠、小肠、阑尾、结肠以及直肠NENs,其中回肠、直肠和阑尾NENs最为常见。早年学术界根据胚胎时期的起源不同,将GI-NENs按照前、中、后肠进行分类。近年来,欧美国家统计NENs发病率较前呈上升趋势(表5)。2.临床特征及预后
2.1胃神经内分泌肿瘤(gastric neuroendocrine neoplasms,g-NENs)2.2十二指肠神经内分泌肿瘤(duodenalneuroendocrine neoplasms,d-NENs)d-NENs可分为十二指肠胃泌素瘤、生长抑素瘤、无功能性d-NENs即没有临床症状但免疫组化提示5-羟色胺或降钙素等为阳性的肿瘤、十二指肠节细胞性副神经节瘤以及NEC。由于壶腹周围与非壶腹周围的d-NENs的临床、病理学和免疫组化等特征有较大差异,可将d-NENs分为壶腹周围NENs及非壶腹周围NENs。50%~60%的壶腹周围NENs存在黄疸,易出现疼痛、呕吐及腹泻等不适。壶腹周围NENs更易伴随NF-1,且25%~100%患者生长抑素的免疫组化为阳性,但是这些肿瘤很少表现出生长抑素分泌相关的临床症状。十二指肠节细胞性副神经节瘤多位于壶腹周围,肿瘤较大,并侵犯粘膜肌层,但多数预后良好。类癌综合征(carcinoid syndrome):在转移性小肠NENs中,有20%~30%的患者可表现类癌综合征,其中分泌性腹泻占60%~80%,面部潮红占60%~85%,还有20%表现为类癌心脏病(carcinoid heart disease,CHD)及右心纤维化。 见表7。
2.4 阑尾 NENs
阑尾NENs的确诊主要依靠组织病理学检测和免疫组化标记。肿瘤≤1cm、浸润深度在浆膜下,或浸润阑尾系膜<3mm、切缘阴性的患者,属于低度恶性,预后较好,阑尾切除术后多无复发风险;而位于阑尾根部、肿瘤>2cm以及深度浸润或切缘阳性的患者复发风险较高,可考虑再次手术,扩大切除右半结肠。症状与结直肠癌类似,大多数为非功能的。没有与激素分泌相关的类癌综合征症状,仅表现为疼痛、肛周坠胀感、贫血及便血等非特异性症状,另外,原发肿瘤或肝脏转移引起的占位效应可引起相应症状。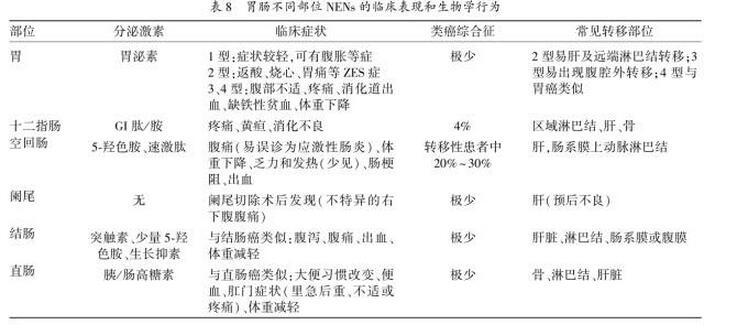
GI-NENs主要通过内镜和镜下活检病理组织学和免疫组化检测诊断,EUS可以协助局部肿瘤的分期和内镜下的息肉切除。内镜活检应当包括最大腺瘤的活检、胃窦部(2块)、胃底(2块)以及胃体(2块)。对于>1~2cm的g-NENs应当行EUS检查。1型g-NENs无需常规行CT、MRI、SRS检查,对于>1~2cm的肿瘤,内镜切除前应行EUS。2型g-NENs由于易合并MEN-1,应当行全身检查。3型和4型g-NENs应该参照胃腺癌进行全身检查。大多数阑尾NENs是在阑尾切除术后发现。对于最大直径<1cm且为R0切除的患者,术后不需要常规影像学随访检查。直径在1到2cm之间、R0切除且分化良好的患者,需行腹部CT或MRI除外淋巴结及远处受侵;而浸润深至阑尾周围组织、血管受侵或>2cm的NENs,应常规行术后CT/MRI联合功能成像检查,但无需行肠镜检查。其他NENs按相应部位的腺癌类型完善全身检查。常规的影像学手段(CT/MRI)及特殊检测手段(如SRS/PET)的具体适用范围,参见pNENs部分。由于原发灶不明NENs多为肺或小肠来源,建议完善胸部CT及胶囊内镜检查(有一定争议)。另外,68Ga PET-CT也有助于发现较为隐匿的原发灶。与pNENs一样,血浆CgA是较灵敏的肿瘤标志物,并且可预测患者预后;但是应用PPI、慢性肾衰、慢性萎缩性胃炎、肝硬化、心衰、肝细胞癌以及甲状腺髓样癌,可能会影响CgA的水平。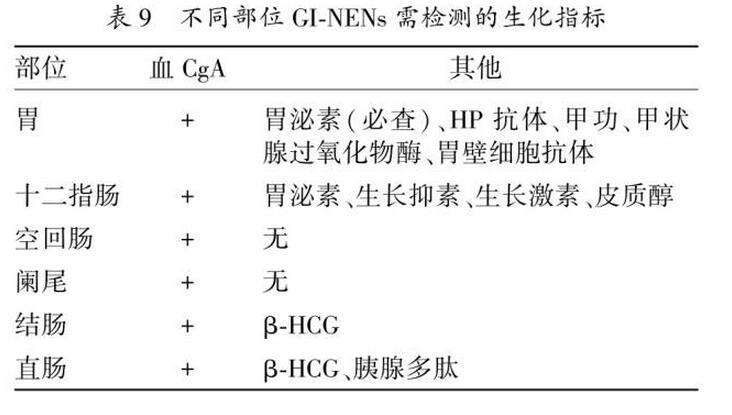
NENs应按病理组织学和增殖活性进行分级,根据核分裂象数和(或)Ki-67标记率两项指标可分为G1、G2和G3,具体内容参见pNENs部分。需要特别指出的是:CD56可作为CgA和Syn的辅助标记;S-100辅助诊断节细胞性副神经节瘤;CgB辅助诊断结直肠NETs;粘液和CEA辅助诊断腺神经内分泌癌。(1)g-NENs:1型g-NENs,<1cm多发肿瘤,经活检证实后可以随访观察。对>1cm的g-NENs,应当行EUS,根据浸润深度和淋巴结转移情况决定内镜下切除还是外科手术切除。2型g-NENs,仅需要行局部切除术。3型的G3和4型g-NENs,应当按照胃癌的处理模式进行手术及术后治疗。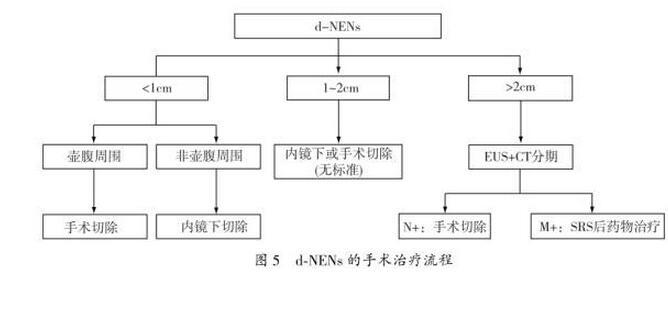
(3)空回肠NENs:根治性切除+淋巴结清扫(包括肠系膜周围淋巴结)为首选的治疗方式;因小肠NENs有多发倾向,术中必须仔细探查全小肠。(4)阑尾NENs:手术方式包括单纯阑尾切除以及右半结肠切除术。(5)结直肠NENs:结肠NENs的根治性手术与结肠腺癌的手术切除范围及淋巴结清扫类似。(6)类癌综合征及相关并发症:类癌综合征应采用SSAs控制症状。对于难治或耐药等情况,可以选择增加SSAs的给药频率,以达到增加剂量的作用。6.2 局部治疗:局部治疗主要是针对肝转移灶的 RFA、TACE 等,可参照pNENs部分。6.3 PRRT:SRS阳性的GI-NENs(G1/G2)患者可考虑PRRT治疗。目前可用于GI-NENs的药物包括SSA、干扰素、依维莫司和化疗等;对于不同分级的患者首选的治疗方案应该不同。其中,对于肿瘤负荷相对较大的G1和G2患者,可以考虑替莫唑胺联合卡培他滨的化疗。对于中肠及后肠NETs,只有在标准治疗均失败后才考虑化疗。NEC G3患者一般首选EP/IP方案,参见pNENs部分。对于无症状的、肿瘤负荷较低同时疾病稳定的NETs患者,可考虑每3~6个月进行肿瘤标志物和影像学的密切随访,直至疾病明显进展。随访应包括生化指标(血浆CgA)、常规影像学检查(CT/MRI)以及内镜检查。对于R0/R1切除的NETs(G1/G2),建议每3~6个月复查CT/MRI;对于NEC(G3)应每2~3个月进行复查。若18~24个月后肿瘤仍然表达生长抑素受体2α,建议随访时包括SRS或68Ga的PET-CT检查。在我国,临床医师已逐渐提高对于GEP-NENS的认识,从起步走向重视的阶段,但是各家中心的实践经验有限,有关文献多是零星的、小样本的病例报道,对于许多问题的认知缺乏充分的循征医学证据加以证实支持。我们在参考国际指南的基础上形成了本共识的新版,主要是希望提醒临床医师在工作中,特别注意GEP-NENS以及与其他疾病的鉴别,规范诊疗行为和提高研究水平;而对于每例具体的患者,应当综合多方面的情况,全面衡量,实施个体化的诊疗。本共识亦将根据有关研究的不断进展,定期加以更新和完善。来源“肿瘤医学论坛”微信
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅
收藏
举报
×
分享到微信
打开微信“扫一扫”,即可分享该文章
发表于:2016-12-13